Termodinâmica
A energia pode se apresentar na natureza sob diversas formas, mas, exceto no caso da energia hidráulica e eólica, deve ser transformada em trabalho mecânico por meio de máquinas, para ser utilizada pelo homem. A termodinâmica nasceu justamente dessa necessidade, e foi o estudo de máquinas térmicas que desenvolveu seus princípios básicos.
Termodinâmica é o ramo da física que estuda as relações entre calor, temperatura, trabalho e energia. Abrange o comportamento geral dos sistemas físicos em condições de equilíbrio ou próximas dele.
Qualquer sistema físico, seja ele capaz ou não de trocar energia e matéria com o ambiente, tenderá a atingir um estado de equilíbrio, que pode ser descrito pela especificação de suas propriedades, como pressão, temperatura ou composição química. Se as limitações externas são alteradas (por exemplo, se o sistema passa a poder se expandir), então essas propriedades se modificam. A termodinâmica tenta descrever matematicamente essas mudanças e prever as condições de equilíbrio do sistema.

Conceitos básicos da Termodinâmica
No estudo da termodinâmica, é necessário definir com precisão alguns conceitos básicos, como sistema, fase, estado e transformação. Sistema é qualquer parte limitada do universo passível de observação e manipulação. Em contraposição, tudo o que não pertence ao sistema é denominado exterior e é dele separado por suas fronteiras.
A caracterização de um estado do sistema é feita por reconhecimento de suas propriedades termodinâmicas. Chama-se fase qualquer porção homogênea de um sistema. O estado depende da natureza do sistema e, para ser descrito, necessita de grandezas que o representem o mais completamente possível. Denomina-se transformação toda e qualquer mudança de estado. Quando formada por uma sucessão de estados de equilíbrio, a transformação é dita reversível.
No estudo da termodinâmica, consideram-se alguns tipos particulares de transformações. A transformação isotérmica é a que se processa sob temperatura constante, enquanto a isobárica é aquela durante a qual não há variação de pressão do sistema. A transformação isométrica se caracteriza pela constância do volume do sistema, a adiabática pela ausência de trocas térmicas com o exterior e a politrópica pela constância do quociente entre a quantidade de calor trocado com o meio externo e a variação de temperatura.
Conhecem-se ainda mais dois tipos de transformação — a isentálpica e a isentrópica — nas quais se observa a constância de outras propriedades termodinâmicas, respectivamente a entalpia (soma da energia interna com o produto da pressão pelo volume do sistema) e a entropia (função associada à organização espacial e energética das partículas de um sistema).
Existem muitas grandezas físicas mensuráveis que variam quando a temperatura do corpo se altera. Em princípio, essas grandezas podem ser utilizadas como indicadoras de temperatura dos corpos. Entre elas citam-se o volume de um líquido, a resistência elétrica de um fio e o volume de um gás mantido a pressão constante.
A equação de estado de uma substância sólida, líquida ou gasosa é uma relação entre grandezas como a pressão (p), a temperatura (t), a densidade (s) e o volume (v). Sabe-se, experimentalmente, que existem relações entre essas grandezas: em princípio, é possível obter uma função do tipo f (p, t, s, v) = 0. Nos casos mais gerais, essas funções são bastante complicadas. Uma forma de estudar as substâncias é representar graficamente a variação de uma grandeza com outra escolhida, estando todas as demais fixas.
Para gases a baixa densidade, podem-se obter equações de estado simples. Nesse caso, observa-se um comportamento geral, que é expresso pela relação:
PV = nRT
em que P é a pressão do gás, V o volume por ele ocupado, T a temperatura, n o número de moles do gás e R uma constante igual a 8,3149 J/kg.mol.K. Para gases de densidades mais elevadas, o modelo do gás ideal (ou perfeito) não é válido. Existem então outras equações de estado, empíricas ou deduzidas de princípios mais fundamentais, como a de van der Waals:
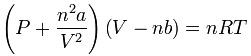
em que a e b são constantes a serem ajustadas para cada gás e v o volume específico molar v = V/n.
Leis da termodinâmica
As principais definições de grandezas termodinâmicas constam de suas leis: a lei zero é a que define a temperatura; a primeira lei (calor, trabalho mecânico e energia interna) é a do princípio da conservação da energia; a segunda lei define entropia e fornece regras para conversão de energia térmica em trabalho mecânico e a terceira lei aponta limitações para a obtenção do zero absoluto de temperatura.
Lei zero
Embora a noção de quente e frio pelo contato com a pele seja de uso corrente, ela pode levar a avaliações erradas de temperatura. De qualquer forma, é da observação cotidiana dos corpos quentes e frios que se chega ao conceito de temperatura. Levando em conta essas observações, assim postulou-se a lei zero: se A e B são dois corpos em equilíbrio térmico com um terceiro corpo C, então A e B estão em equilíbrio térmico um com o outro, ou seja, a temperatura desses sistemas é a mesma.
Primeira lei
A lei de conservação de energia aplicada aos processos térmicos é conhecida como primeira lei da termodinâmica. Ela dá a equivalência entre calor e trabalho e pode enunciar-se da seguinte maneira: “em todo sistema quimicamente isolado em que há troca de trabalho e calor com o meio externo e em que, durante essa transformação, realiza-se um ciclo (o estado inicial do sistema é igual a seu estado final), as quantidades de calor (Q) e trabalho (W) trocadas são iguais.
Assim, chega-se à expressão W = JQ, em que J é uma constante que corresponde ao ajuste entre as unidades de calor (usada na medida de Q) e Joule (usada na medida de W). Essa constante é empregada na própria definição de caloria (1 cal = 4,1868J).
A primeira lei da termodinâmica pode ser enunciada também a partir do conceito de energia interna, entendida como a energia associada aos átomos e moléculas em seus movimentos e interações internas ao sistema. Essa energia não envolve outras energias cinéticas e potenciais, que o sistema como um todo apresenta em suas relações com o exterior.
A variação da energia interna DU é medida pela diferença entre a quantidade de calor (Q), trocado pelo sistema com seu exterior, e o trabalho realizado (W) e é dada pela expressão DU = K – W , que corresponde ao enunciado da lei da termodinâmica. É comum no estudo das transformações o uso da função termodinâmica da entalpia (H), definida pela relação H = U + pV, em que U é a energia interna, p é a pressão e V é o volume do sistema. Num processo em que só existe trabalho de expansão (como, por exemplo, na fusão sob pressão e temperatura constante), a entalpia é a medida do calor trocado entre o sistema e seu exterior.
A relação entre a variação DQ e o aumento correspondente de temperatura Dt, no limite, quando Dt tende a zero, é chamada capacidade calorífica do sistema:
C = DQ/Dt
O calor específico é igual à capacidade calorífica dividida pela massa do sistema:
C = 1 D Q / m D t
Tanto o calor específico quanto a capacidade calorífica do sistema dependem das condições pelas quais foi absorvido ou retirado calor do sistema.
Segunda lei
A tendência do calor a passar de um corpo mais quente para um mais frio, e nunca no sentido oposto, a menos que exteriormente comandado, é enunciada pela segunda lei da termodinâmica. Essa lei nega a existência do fenômeno espontâneo de transformação de energia térmica em energia cinética, que permitiria converter a energia do meio aquecido para a execução de um movimento (por exemplo, mover um barco com a energia resultante da conversão da água em gelo).
De acordo com essa lei da termodinâmica, num sistema fechado, a entropia nunca diminui. Isso significa que, se o sistema está inicialmente num estado de baixa entropia (organizado), tenderá espontaneamente a um estado de entropia máxima (desordem). Por exemplo, se dois blocos de metal a diferentes temperaturas são postos em contato térmico, a desigual distribuição de temperatura rapidamente dá lugar a um estado de temperatura uniforme à medida que a energia flui do bloco mais quente para o mais frio. Ao atingir esse estado, o sistema está em equilíbrio.
A entropia, que pode ser entendida como decorrente da desordem interna do sistema, é definida por meio de processos estatísticos relacionados com a probabilidade de as partículas terem determinadas características ao constituírem um sistema num dado estado. Assim, por exemplo, as moléculas e átomos que compõem 1kg de gelo, a 0o C e 1atm, apresentam características individuais distintas, mas do ponto de vista estatístico apresentam, no conjunto, características que definem a possibilidade da existência da pedra de gelo nesse estado.
A variação da função entropia pode ser determinada pela relação entre a quantidade de calor trocada e a temperatura absoluta do sistema. Assim, por exemplo, a fusão de 1kg de gelo, nas condições de 273K e 1atm, utiliza 80.000cal, o que representa um aumento de entropia do sistema, devido à fusão, em 293J/K.
A aplicação do segundo princípio a sistemas de extensões universais esbarra em dificuldades conceituais relativas à condição de seu isolamento. Entretanto, pode-se cogitar de regiões do universo tão grandes quanto se queira, isoladas das restantes. Para elas (e para as regiões complementares) valeria a lei do crescimento da entropia. Pode-se então perguntar por que motivo o universo não atingiu ainda a situação de máxima entropia, ou se atingirá essa condição um dia.
A situação de máxima entropia corresponde à chamada morte térmica do universo: toda a matéria estaria distribuída na vastidão espacial, ocupando uniformemente os estados possíveis da energia. A temperatura seria constante em toda parte e nenhuma forma de organização, das mais elementares às superiores, seria possível.
Terceira lei
O conceito de temperatura entra na termodinâmica como uma quantidade matemática precisa que relaciona calor e entropia. A interação entre essas três quantidades é descrita pela terceira lei da termodinâmica, segundo a qual é impossível reduzir qualquer sistema à temperatura do zero absoluto mediante um número finito de operações. De acordo com esse princípio, também conhecido como teorema de Nernst, a entropia de todos os corpos tende a zero quando a temperatura tende ao zero absoluto.
Termodinâmica estatística
As leis da termodinâmica são obtidas experimentalmente, mas podem ser deduzidas a partir de princípios mais fundamentais, por meio da mecânica estatística, desenvolvida sobretudo por Josiah Willard Gibbs e Ludwig Boltzmann. O propósito fundamental da termodinâmica estatística é o de interpretar grandezas macroscópicas, como temperatura, energia interna e pressão, em termos das grandezas dinâmicas, e reescrever os princípios da termodinâmica em termos das leis gerais que as afetam.
A energia interna, U, é por si uma grandeza mecânica e dispensa interpretações adicionais. A análise se concentra, portanto, nas interpretações mecânicas da temperatura e da entropia. Os fundamentos da termodinâmica estatística foram estabelecidos a partir de meados do século XIX por Rudolf Julius Emanuel Clausius, James Clerk Maxwell e Ludwig Boltzmann. A interpretação mecânica da temperatura deve muito aos trabalhos dos dois primeiros cientistas sobre o comportamento dos gases. Maxwell demonstrou que a temperatura T de um gás ideal em equilíbrio está relacionada com a energia cinética média de suas moléculas (E) por E = 3/2 k.T, em que k é a constante de Boltzmann.
Seus trabalhos foram posteriormente desenvolvidos por Boltzmann e levaram a uma generalização importante desse resultado, conhecida como equipartição da energia: o valor médio da energia de um sistema cujo movimento microscópico tem s graus de liberdade (números de coordenadas de posição e de impulso que determinam as energias de translação, vibração e rotação de uma molécula), em equilíbrio termodinâmico à temperatura T, distribui-se igualmente entre os diferentes graus de liberdade, de tal modo que cada um contribui com k.T/2 para a energia total. Assim, para s graus de liberdade,E = s/2 k.T. Para gases monoatômicos, o movimento de cada molécula tem apenas três graus de liberdade de translação. Para gases diatômicos, além da translação, haverá vibrações e rotações, num total de seis graus de liberdade.
A falha na previsão do valor correto para o calor específico a volume constante de gases diatômicos (e também de sólidos cristalinos monoatômicos) foi o primeiro exemplo histórico da inadequação dos conceitos e métodos da mecânica clássica para o tratamento dos movimentos microscópicos. Essa e outras contradições com a formulação teórica da equipartição da energia de Maxwell-Boltzmann vieram a ser elucidadas posteriormente, à luz dos argumentos da mecânica quântica.
História
A temperatura é provavelmente o primeiro conceito termodinâmico. No final do século XVI, Galileu Galilei inventou um termômetro rudimentar, o termoscópio, ao qual se seguiram outros inventos com a mesma finalidade. O objetivo desses instrumentos era medir uma quantidade até então indefinida, mais objetiva na natureza do que as sensações fisiológicas de calor e frio. Na época, acreditava-se que a temperatura fosse uma potência motriz que provoca a transmissão de um certo eflúvio de um corpo quente para outro mais frio. Mas não se sabia explicar ainda o que era transmitido entre os corpos.
Francis Bacon, em 1620, e a Academia Florentina, alguns anos depois, começaram a fazer a distinção entre essa emanação e a temperatura. Somente em 1770, porém, o químico Joseph Black, da Universidade de Glasglow, diferenciou-as de maneira clara. Misturando massas iguais de líquidos a diferentes temperaturas, ele mostrou que a variação de temperatura em cada uma das substâncias misturadas não é igual em termos quantitativos.
Black fundou a ciência da calorimetria, que levou à enunciação da teoria segundo a qual o calor é um fluido invisível chamado calórico. Um objeto se aquecia quando recebia calórico e se esfriava quando o perdia. A primeira evidência de que essa substância não existia foi dada, no final do século XVIII, pelo conde Rumford (Benjamin Thompson). Demonstrou-se, posteriormente, que o que se troca entre corpos de temperaturas diferentes é a energia cinética de seus átomos e moléculas, energia também conhecida como térmica.
Em 1824, Sadi Carnot, um engenheiro militar francês, tornou-se o primeiro pesquisador a preocupar-se com as características básicas das máquinas térmicas e a estudar o problema de seu rendimento. A contribuição de Carnot à solução do problema, embora teórica, foi de importância fundamental, pois demonstrou as características realmente significativas do funcionamento das máquinas térmicas, ou seja: (1) que a máquina recebe de uma fonte qualquer certa quantidade de calor a temperatura elevada; (2) que ela executa um trabalho externo; e (3) que rejeita calor a temperatura mais baixa do que a correspondente ao calor recebido.
Apesar de fundamentar suas teorias na noção de que o calor é um fluido imponderável, o calórico, Carnot encontrou a expressão correta do rendimento máximo que se pode obter com uma máquina térmica qualquer, operando entre duas fontes de temperaturas diferentes. Na década de 1840, James Prescott Joule assentou as bases da primeira lei da termodinâmica ao mostrar que a quantidade de trabalho necessária para promover uma determinada mudança de estado é independente do tipo de trabalho (mecânico, elétrico, magnético etc.) realizado, do ritmo e do método empregado.
Joule concluiu que o trabalho pode ser convertido em calor e vice-versa. Em 1844, Julius Robert von Mayer deduziu a lei de equivalência do calor e do trabalho, segundo a qual, num ciclo produtor de trabalho, o calor introduzido deve exceder o calor rejeitado em uma quantidade proporcional ao trabalho e calculou o valor da constante de proporcionalidade.
Em 1849, Lord Kelvin (William Thomson), engenheiro de Glasgow, mostrou o conflito existente entre a base calórica dos argumentos de Carnot e as conclusões obtidas por Joule. No ano seguinte, Rudolf Julius Emanuel Clausius solucionou o problema ao enunciar a primeira e a segunda leis da termodinâmica. Alguns anos depois, Clausius definiu a função da entropia, que se conserva em todas as transformações reversíveis, e deduziu da segunda lei da termodinâmica o princípio do aumento da entropia.
A publicação dos estudos de Clausius em 1850 marca o nascimento da ciência termodinâmica. De 1873 a 1878, Josiah Gibbs criou um método matemático que serviu como base para a fundação da termodinâmica química e para diversas aplicações da termodinâmica clássica. No início do século XX, Henri Poincaré elaborou as equações matemáticas das leis de Clausius, e Constantin Carathéodory apresentou uma estrutura lógica alternativa das teorias termodinâmicas que evitava o termo calor, considerado obsoleto. Em 1918, o Prêmio Nobel Walther Nernst, enunciou o princípio de Nernst, que coincide essencialmente com a terceira lei da termodinâmica.
Autoria: Carlos José da Silva Costa



0 Comentários